Los gases
Los gases son sustancias, que la mayoría de
Por sus partículas, moléculas o composición
Química.
La densidad de un gas es algo difícil
De medir, es por eso que se usan aparatos
Especiales, hay varios tipos de gases como los
Nobles, argón, helio, neón, etc.… con diferente
Composición quimica,en el gas sus moléculas
Nunca están quietas o en un solo lugar.
¿Que es un gas?
 Se denomina gas al estado de agregacion de la materia en el que las sustancias no tienen forma ni volumen propio, adoptando el de los recipientes que las contienen. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras.
Se denomina gas al estado de agregacion de la materia en el que las sustancias no tienen forma ni volumen propio, adoptando el de los recipientes que las contienen. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras.Propiedades de los gases y características
 Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven las moléculas.
Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven las moléculas.Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
Ley general de los gases
Aqui hay un video donde explican las leyes el comportamiento y caracteristicas de los gases, conforme a cada ley: en caso que no se vea aqui esta el enlace http://www.youtube.com/watch?v=Nk8audj7R5A
Gases reales
Si se quiere afinar más o si se quiere medir el comportamiento de algún gas que escapa al comportamiento ideal, habrá que recurrir a las ecuaciones de los gases reales, que son variadas y más complicadas cuanto más precisas.
Los gases reales no se expanden infinitamente, sino que llegaría un momento en el que no ocuparían más volumen. Esto se debe a que entre sus partículas, ya seas atomos como en los gases nobles o moleculas como en el (O2) y la mayoría de los gases. O incluso el aire y nubes.
Comportamiento de los gases
Cualquier gas se considera como un fluido, porque tiene las propiedades que le permiten comportarse como tal.
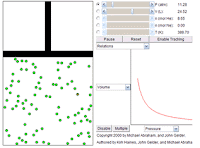 Sus moléculas, en continuo movimiento, colisionan elasticamente entre sí y contra las paredes del recipiente que contiene al gas, contra las que ejercen una presión permanente.
Sus moléculas, en continuo movimiento, colisionan elasticamente entre sí y contra las paredes del recipiente que contiene al gas, contra las que ejercen una presión permanente.Ley de los gases ideales
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservacion de momento y energía cinetica). Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatomicos en condiciones de baja presión y alta temperatura.
Empíricamente, se observan una serie de relaciones entre la temperatura, la presion y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Emile Clapeyron en 1834.
Teoría cinética molecular
Esta teoría fue desarrollada por Ludwig Boltzmann y Maxwell. Nos indica las propiedades de un gas ideal a nivel molecular.
- Todo gas ideal está formado por N pequeñas partículas puntuales (átomos o moléculas).
- Las moléculas gaseosas se mueven a altas velocidades, en forma recta y desordenada.
- Un gas ideal ejerce una presión continua sobre las paredes del recipiente que lo contiene, debido a los choques de las partículas con las paredes de este.
- Los choques moleculares son perfectamente elásticos. No hay pérdida de energía cinética.
- No se tienen en cuenta las interacciones de atracción y repulsión molecular.
- La energia cinetica media de la translación de una molécula es directamente proporcional a la temperatura absoluta del gas.
En estas circunstancias, la ecuación de los gases se encuentra teóricamente:
Ley de Boyle-Mariotte
También llamado proceso isotérmico. Afirma que, a temperatura y cantidad de gas constante, la presión de un gas es inversamente proporcional a su volumen:
Proceso isobaro ( Charles)
Proceso isocoro ( Gay Lussac)
Ley de Avogadro
La Ley de Avogadro fue expuesta por Amedeo Avogadro en 1811 y complementaba a las de Boyle, Charles y Gay-Lussac. Asegura que en un proceso a presión y temperatura constante (isobaro e isotermo), el volumen de cualquier gas es proporcional al número de moles presente, de tal modo que:
Esta ecuación es válida incluso para gases ideales distintos. Una forma alternativa de enunciar esta ley es:
El volumen que ocupa un mol de cualquier gas ideal a una temperatura y presión dadas siempre es el mismo.
 Bueno pues esta es informacion aparte, es sobre los gases, los cuales la mayoria causan o ayudan a acelerar mas el efecto invernadero, como es el caso de co2 o mejor conocido como el dioxido de carbono el cual es arrojado por los carros, motos, camiones, etc.. Este efecto causa el llamado calentamiento global, que ha producido grandes cambios en el clima asi como el derretimiento de las capas glaciales de los polos. Otro efecto de algunos gases es que gracias a su alto consumo y su estructura destruyen la capa de ozono ocasionando que mas rayos del sol entren a la tierra aumentando el calor y en ocaciones causar cancér en la piel, se cree que si sigue asi se rompera por completo y habrá mucho cancér en la piel, esto es en lo que estos gases afectan en la actualidad.
Bueno pues esta es informacion aparte, es sobre los gases, los cuales la mayoria causan o ayudan a acelerar mas el efecto invernadero, como es el caso de co2 o mejor conocido como el dioxido de carbono el cual es arrojado por los carros, motos, camiones, etc.. Este efecto causa el llamado calentamiento global, que ha producido grandes cambios en el clima asi como el derretimiento de las capas glaciales de los polos. Otro efecto de algunos gases es que gracias a su alto consumo y su estructura destruyen la capa de ozono ocasionando que mas rayos del sol entren a la tierra aumentando el calor y en ocaciones causar cancér en la piel, se cree que si sigue asi se rompera por completo y habrá mucho cancér en la piel, esto es en lo que estos gases afectan en la actualidad.
 Como reflexion personal digo que debemos preocuparnos de que esto no pase y dejar de usar tantos gases como en aerosoles, carros o al quemar algo, y así se podra evitar tanto el infecto invernadero como el calentamiento global, ya que este es un hecho de actualidad y es muy importante para todos nosotros....
Como reflexion personal digo que debemos preocuparnos de que esto no pase y dejar de usar tantos gases como en aerosoles, carros o al quemar algo, y así se podra evitar tanto el infecto invernadero como el calentamiento global, ya que este es un hecho de actualidad y es muy importante para todos nosotros.... 




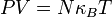






hola...me agrado mucho tu blog, pero seria mejor en enfocarte solo en un area especifica del tema para entenderlo mejor.pero muy bien las imagenes y muy completo, bien estructurado.
ResponderEliminar